近日,秦岭研究院中草药研究利用中心高锦明教授团队在秦巴山区特色天然药物新资源发掘研究领域取得新进展。相关研究成果以“Hyperforatone A, the 1,8-seco rearranged polycyclic polyprenylated acylphloroglucinol with a unique bicyclo[5.4.0]undecane core from Hypericum perforatum”为题发表在《Chinese Chemical Letters》(2025, 36, 110478,大类一区,TOP,IF = 9.5)上。2020级博士研究生刘武阳为论文第一作者,高锦明教授和田均勉副教授为共同通讯作者。
从贯叶连翘地上部分的石油醚提取物中发现了结构新颖的1,8-seco-PPAP化合物hyperforatone A(1)。通过光谱分析、残余偶极耦合(RDCs)等计算方法和单晶X射线衍射分析确定了1的平面结构和绝对构型。该化合物具有罕见的双环[5.4.0]十一烷碳骨架,为5/7/6/5环体系。DFT计算表明,阳离子环化反应是1形成的关键反应机理。在脂多糖诱导的BV-2小胶质细胞和斑马鱼模型中,1可通过抑制NO生成和神经元凋亡来发挥抗神经炎症作用。
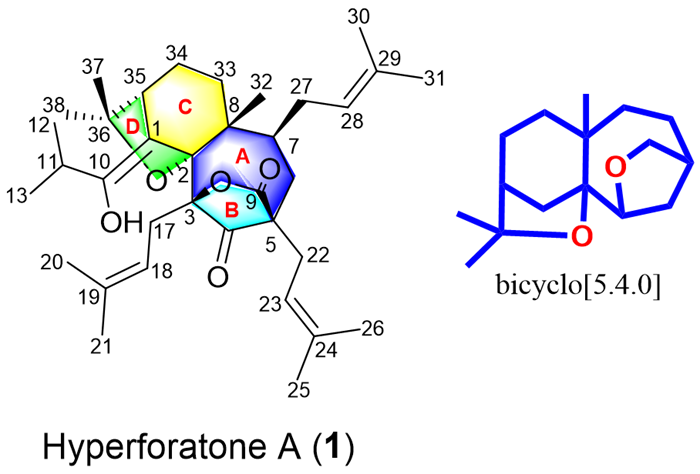
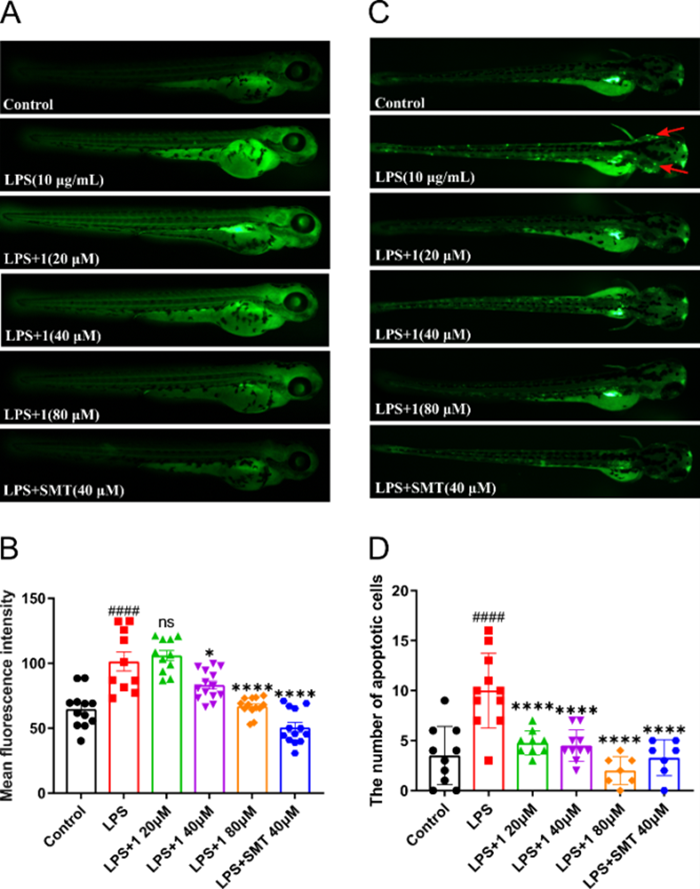
图 1 化合物1的结构及对LPS诱导的斑马鱼体内NO生成和神经元凋亡的影响(A, C荧光显微镜下观察NO生成和神经元凋亡/B, D利用图像定量平均荧光强度和凋亡细胞数)
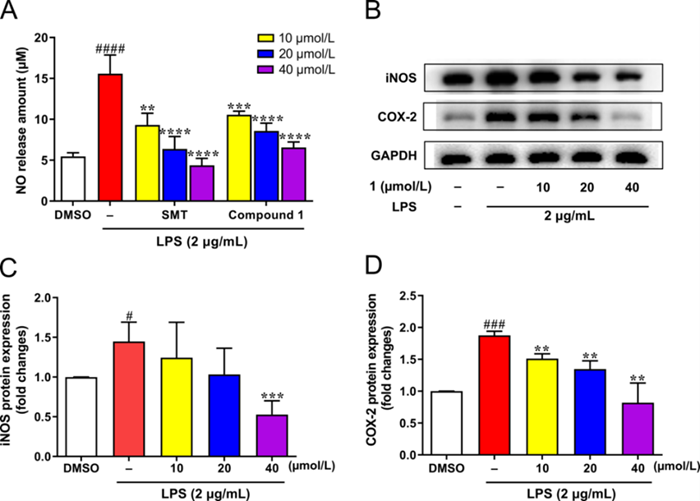
图2 化合物 1抑制NO 及iNOS 和 COX-2表达
工作亮点
1. 化合物结构新颖:从贯叶连翘中提取分离到双环[5.4.0]十一烷碳骨架的1,8-seco-PPAP hyperperforatone A(1)。
2. 结构解析方法综合全面:通过多种技术手段确定其结构和绝对构型,综合光谱数据、巧妙运用各类计算方法(如RDCs)以及单晶X射线衍射分析,准确解析复杂天然产物的结构。
3.提出新的生物合成途径:基于密度泛函理论(DFT)计算,提出1可能的生物合成途径,表明阳离子环化反应在化合物1形成机制的关键作用,在能量上更利于发生,为理解1,8-seco-PPAPs的生物合成提供了新的见解。
4. 生物活性研究:化合物1在LPS诱导的BV-2小胶质细胞和斑马鱼中显示出显著的抗神经炎症作用,为开发抗神经炎症药物提供了新的潜在候选物。
该研究得到国家自然科学基金、陕西省重点研发计划秦创原“科学家+工程师”队伍建设项目、陕西省中医药管理局秦创原“产学研用”科研创新项目,以及学校双一流学科建设项目资助。
原文链接:https://doi.org/10.1016/j.cclet.2024.110478
终审:高锦明

